Nouvelles
Explorer de nouveaux horizons dans la signalisation RAS mène à de nombreuses surprises
Publié le 14 October 2020
Il existe plus de 160 petites protéines GTPases dans les cellules humaines qui peuvent fluctuer entre un état actif (« on ») et un état inactif (« off »). Celles-ci fonctionnent comme des commutateurs qui contrôlent l’activité des voies de signalisation intracellulaires. Les GTPases de la famille RAS sont particulièrement importantes. Les mutations de ces GTPases sont parmi les principales causes des cancers chez l’humain, mais il n’existe actuellement aucun médicament ciblant les protéines RAS elles-mêmes.
Des protéines « effectrices » agissent conjointement avec les RAS en formant des complexes avec les RAS activées qu’elles reconnaissent, pour relayer les signaux en aval. Elles soutiennent ainsi l’activité des voies de signalisation qui stimulent des processus tels que la prolifération cellulaire. Ces protéines effectrices sont des cibles thérapeutiques intéressantes, et une meilleure compréhension de leurs fonctions pourrait avoir un impact significatif sur le diagnostic, le traitement et la rémission des patients cancéreux.
Les protéines RASSF, intrigantes, mais mal connues
Le groupe du professeur Matthew Smith de l’IRIC et ses collaborateurs de l’Université hébraïque de Jérusalem ont entrepris une analyse systématique des protéines effectrices peu étudiées de la famille RAS-association domain family (RASSF). Leurs découvertes surprenantes viennent d’être publiées dans la revue Science Signaling. Les protéines RASSF sont très intrigantes, car on pense qu’elles agissent comme des suppresseurs de tumeurs en reliant directement la voie RAS avec au moins une autre voie de signalisation importante, la voie Hippo, pour induire la mort cellulaire au lieu de la prolifération. Pourtant, le rôle spécifique des 10 protéines de cette famille dans la signalisation en aval des RAS et la question à savoir si les 10 sont de véritables effecteurs de RAS, restaient jusqu’à présent sans réponses.
Plusieurs surprises
Les chercheurs ont d’abord généré des formes purifiées de ces protéines RASSF comme outils expérimentaux pour tester leurs interactions avec les GTPases RAS activées. À leur grande surprise, un seul des dix membres de la famille, RASSF5, lie les RAS activées. Contrairement aux études précédentes, ils ont constaté qu’aucun RASSF ne stimule la mort cellulaire programmée (apoptose) en aval des oncoprotéines RAS. Fait intéressant cependant, RASSF1-6 s’associe à la kinase Hippo de mammifères, et les autres RASSF interagissent avec les régulateurs de p53, un suppresseur de tumeur important ayant une fonction pro-apoptotique.
Nouveaux partenaires de liaison
Ayant découvert que la plupart des RASSFs n’interagissent pas avec les oncoprotéines GTPases RAS, les chercheurs ont ensuite mesuré directement leurs interactions avec des GTPases apparentées, précédemment proposées comme partenaires de RASSFs. Ils n’ont pu corroborer aucune interaction entre les RASSFs et l’une de ces cibles potentielles, ce qui suggère que les GTPases apparentées à RAS qui signalent à travers ces effecteurs demeurent inconnues. Ils ont construit des modèles structurels pour les RASSFs afin de guider leur recherche de nouveaux partenaires de liaison potentiels. Cette approche informatique basée sur la structure et la séquence des protéines a conduit à l’identification de six nouvelles GTPases partenaires (y compris des GTPases de la famille RGK) pour la protéine RASSF1, un suppresseur de tumeur bien connu. Observation importante, l’interaction entre RASSF1 et ces GTPases RGK active la voie apoptotique Hippo dans les cellules.
Cette analyse systématique des partenaires de liaison RASSF est une première étape importante dans la définition des mécanismes moléculaires à travers lesquels ces effecteurs couplent différents membres de la sous-famille RAS à la voie Hippo. Comme la signalisation Hippo est une caractéristique émergente des cancers induits par RAS et de leur résistance aux thérapies, ces données faciliteront à terme le développement de nouvelles thérapies à utiliser en conjonction avec d’autres inhibiteurs, afin d’arrêter définitivement la croissance des cellules cancéreuses induites par RAS et prévenir les rechutes.
Étude citée
Dhanaraman, T., S. Singh, R.C. Killoran, A. Singh, X. Xu, J. Shifman, M.J. Smith.
RASSF effectors couple diverse RAS subfamily GTPases to the Hippo pathway
Science Signaling.
https://stke.sciencemag.org/content/13/653/eabb4778
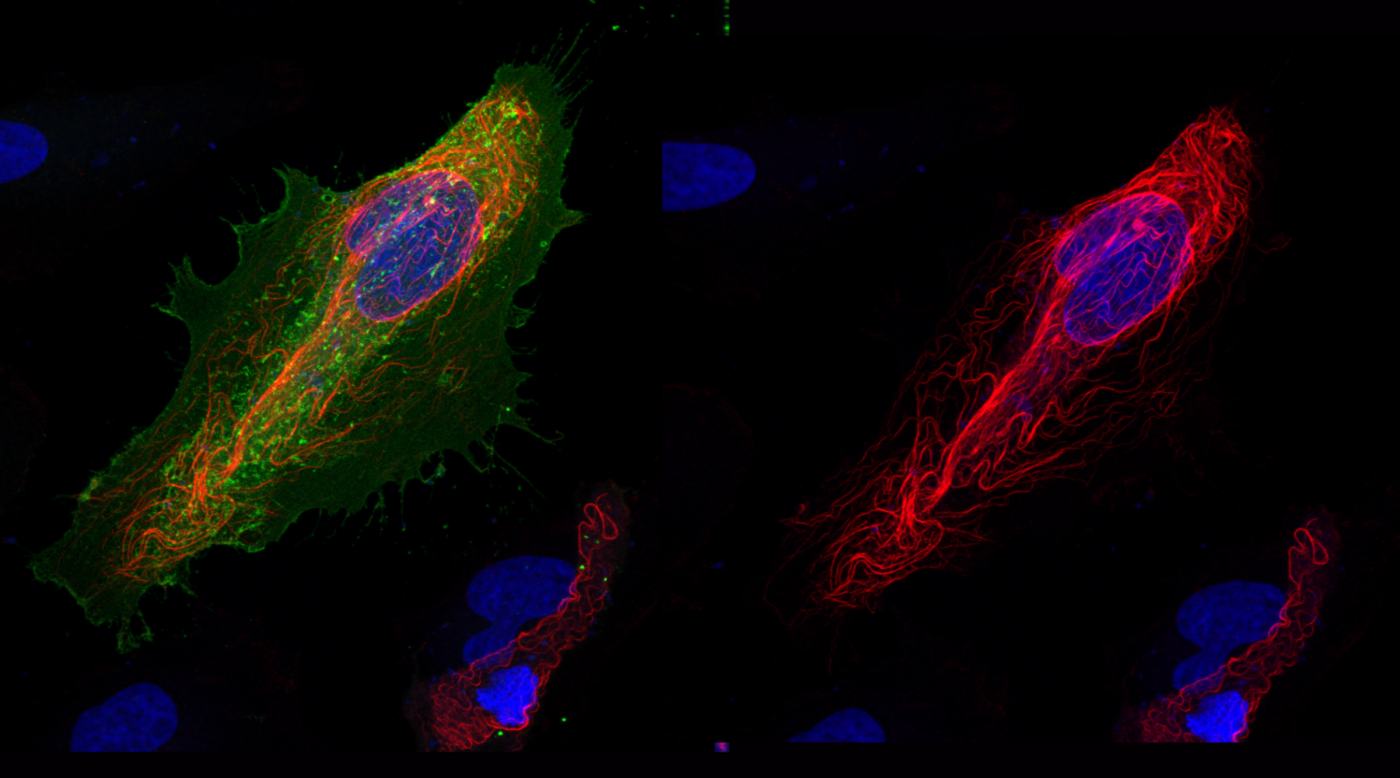
Légende photo
La liaison de la GTPase de la sous-famille RAS aux protéines effectrices est hautement dynamique, étroitement régulée et peut avoir un impact significatif sur la physiologie cellulaire. Dans les cellules HeLa en interphase, RASSF1 réside sur des microtubules (en rouge) tandis que la petite GTPase REM1 (verte) liée au RAS est localisée au niveau de la membrane plasmique.