Nouvelles
TMEM16F: une protéine avec un rôle clé dans la régulation de l’activité des lymphocytes T
Publié le 1er avril 2021
Par Fatéma Dodat
Comprendre la régulation de l’activité des cellules T représente un enjeu crucial pour le développement d’une immunité contre les infections, mais aussi dans le cancer. Une étude menée par l’équipe du chercheur Etienne Gagnon révèle que TMEM16F, une molécule favorisant l’échange des constituants entre les feuillets de la bicouche lipidique d’une membrane cellulaire, est impliquée dans cette activation. Récemment publiés dans Science Signaling, ces travaux permettent d’élucider la cascade d’événements menant à l’activation robuste des cellules T. Cette étude accroît le nombre de cibles potentielles afin d’améliorer l’activation de la réponse immunitaire dépendante des cellules T. Par ailleurs, elle ouvre la voie vers des stratégies de thérapies anticancéreuses.
Les actrices de l’immunité adaptative : les cellules T
Lorsque des organismes pathogènes pénètrent à l’intérieur de l’hôte, l’immunité adaptative est sollicitée à travers l’activation des cellules spécialisées appelées lymphocytes T qui sont les chefs d’orchestre de la réponse immunitaire. En effet, des cellules présentatrices d’antigènes (CPA) présentent des parties des éléments « intrus » aux lymphocytes T, au niveau d’une interface spécialisée entre ces deux cellules appelée la synapse immunologique, ce qui permet de développer une réponse immunitaire adaptée à l’intrus en question.
L’initiation de la réponse immunitaire adaptative passe par l’activation du récepteur des cellules T, appelé TCR, un complexe protéique regroupant 8 protéines. Parmi ces protéines figurent les composantes CD3 qui assurent la signalisation du TCR et donc l’activation de la cellule T. Au repos, le TCR demeure à l’état de dormance grâce à des interactions électrostatiques entre les domaines intracellulaires des protéines CD3, contenant des charges positives, et la membrane plasmique de la cellule T dont le feuillet interne est riche en lipides ayant une charge négative -principalement la phosphatidylsérine. Lorsque le TCR reconnait un antigène présenté par une CPA, il forme des agrégats et exclut ainsi la phosphatidylsérine, permettant alors aux chaines CD3 de se dissocier le la membrane plasmique pour engager la signalisation. Cependant, la phosphatidylsérine peut aussi être redistribuée vers le feuillet externe de la membrane plasmique par des enzymes particulières appelées scramblases. Une scramblase ayant gagné de l’attention ces dernières années pour son implication dans l’activation les cellules T est la protéine TMEM16F. Cependant, son rôle exact dans ce processus demeurait à ce jour inconnu.
TMEM16F : une activatrice de la signalisation des cellules T
Lors de cette étude, les auteurs ont mis en évidence que l’activation de TMEM16F par le calcium engage la redistribution de la phosphatidylsérine vers le feuillet externe de la membrane plasmique et entraîne une diminution du potentiel électrostatique. Cette diminution est concomitante à la formation de la synapse immunologique et engendre par ailleurs une augmentation de la dissociation des domaines cytoplasmiques du complexe TCR-CD3 de la membrane plasmique et amplifie la signalisation qui est dépendante du TCR. Par conséquent, l’activation des lymphocytes T est également augmentée.
Cette étude démontre l’importance du rôle de TMEM16F dans l’amplification de la signalisation induite par l’activité des TCR et fournit les premières bases moléculaires pour comprendre cette régulation. En modulant les interactions électrostatiques, la protéine TMEM16F régit l’activité des TCRs et conduit à l’activation robuste des cellules T. Ainsi, les travaux de l’équipe d’Etienne Gagnon permettent d’élargir les cibles potentielles impliquées dans l’activation de la réponse immunitaire dépendante des cellules T. En plus de mieux comprendre cette régulation cruciale dans la réponse immunitaire adaptative, ces découvertes offrent l’opportunité de développer des stratégies immunitaires contre le cancer, notamment en ce qui a trait aux thérapies employant la technologie des récepteurs antigénique chimériques, communément appelés CARs.
Étude citée
TMEM16F mediates bystander TCR-CD3 membrane dissociation at the immunological synapse and potentiates T cell activation
Science Signaling
Audrey Connolly, Rébecca Panes, Margaux Tual, Raphaël Lafortune, Angélique Bellemare-Pelletier, Etienne Gagnon
https://stke.sciencemag.org/content/14/675/eabb5146
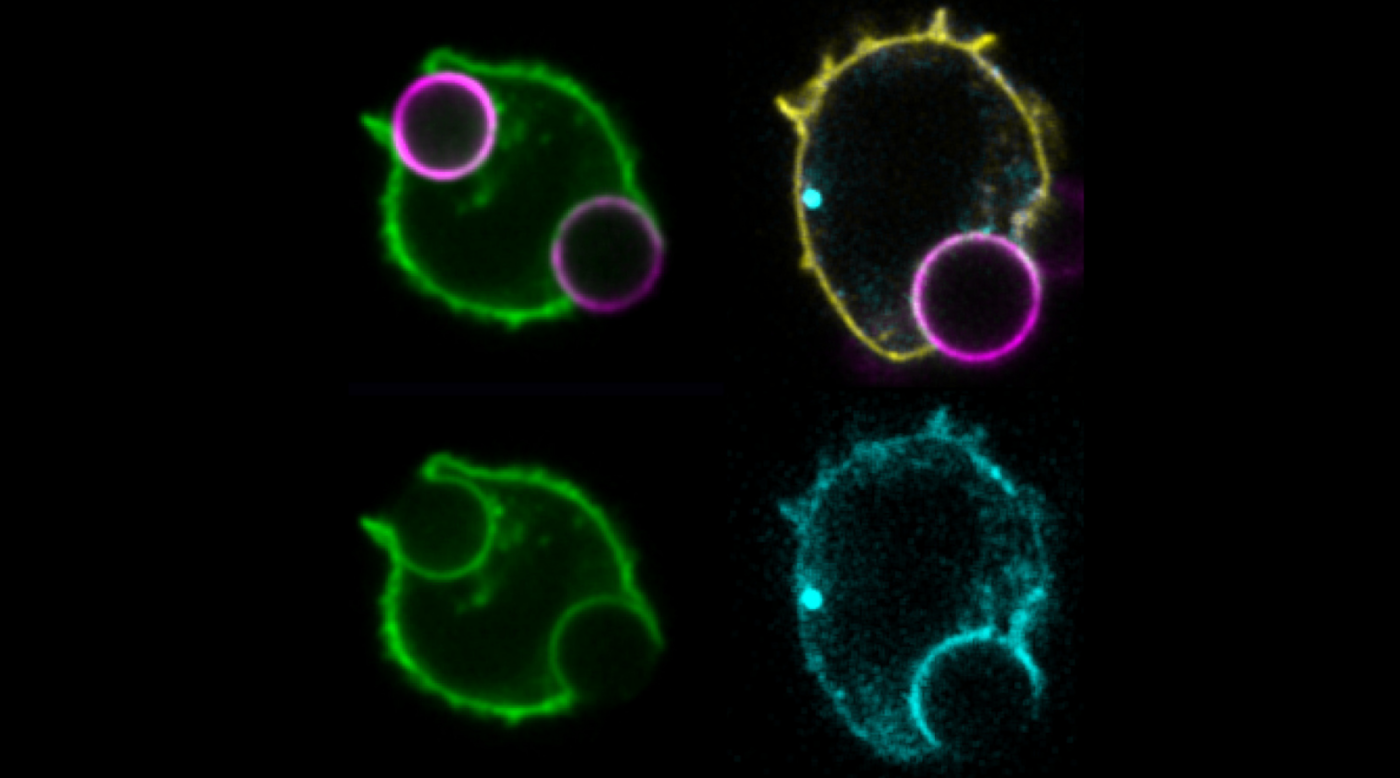
Légende photo
Les cellules T formant une synapse immunitaire redistribuent la phosphatidylsérine (PS) vers l’extérieur des cellules pour diminuer sa présence sur le feuillet interne de la membrane plasmique. Ceci peut être observé par une réduction de l’intensité de fluorescence d’une sonde spécifique de la PS (vert) dans les membranes qui sont en contact avec les billes activatrices (magenta), appelée la synapse immunologique. Une réduction de la PS au niveau de la synapse permet la dissociation du TCR-CD3 secondaire (cyan), ce qui peut être observé par une augmentation du signal de fluorescence au niveau de la membrane plasmique en contact avec les billes activatrices (magenta) et est causée par la réduction du transfert d’énergie entre la chaîne TCR-CD3 et son partenaire, une protéine fluorescente ciblant la membrane plasmique (jaune).