Nouvelles
La coordination spatiotemporelle: un aspect clé permettant aux cellules de se diviser correctement
Publié le 13 avril 2021
Les enzymes régulatrices de la division cellulaire doivent être soumises à un contrôle spatiotemporel leur permettant d’accéder aux structures cellulaires qu’elles contrôlent seulement au moment opportun. La ségrégation des chromosomes durant la mitose est l’événement le plus crucial de la division cellulaire. La coordination spatiotemporelle est donc fondamentale au bon déroulement de la mitose. Malgré cela, cette dimension demeure mal comprise à ce jour. L’équipe du professeur Vincent Archambault de l’IRIC a récemment découvert de nouveaux mécanismes de fonctionnement du module moléculaire formé par Greatwall, Endos et PP2A-B55, trois protéines régulatrices de la mitose. Le travail de recherche a été mené par la doctorante en Biochimie Myreille Larouche en compagnie du postdoctorant David Kachaner et fait l’objet d’un article publié en avril dans le Journal of Cell Biology.
Une division précisément orchestrée
Les cellules des organismes multicellulaires se multiplient grâce à la division cellulaire mitotique. Essentielle à divers processus normaux (développement, guérison, régénérescence tissulaire), la division cellulaire peut causer des pathologies comme le cancer lorsqu’elle devient chaotique. La mitose nécessite d’importants événements à l’intérieur de la cellule qui doivent être finement coordonnés dans le temps et dans l’espace pour éviter tout défaut. Il est par exemple important que le génome de la cellule soit correctement dupliqué avant que les chromosomes ne se condensent. De la même manière, il est nécessaire que l’enveloppe nucléaire, barrière permettant de protéger le génome, se désassemble avant que ne s’amorce la séparation des paires de chromosomes entre les deux cellules-filles naissantes.
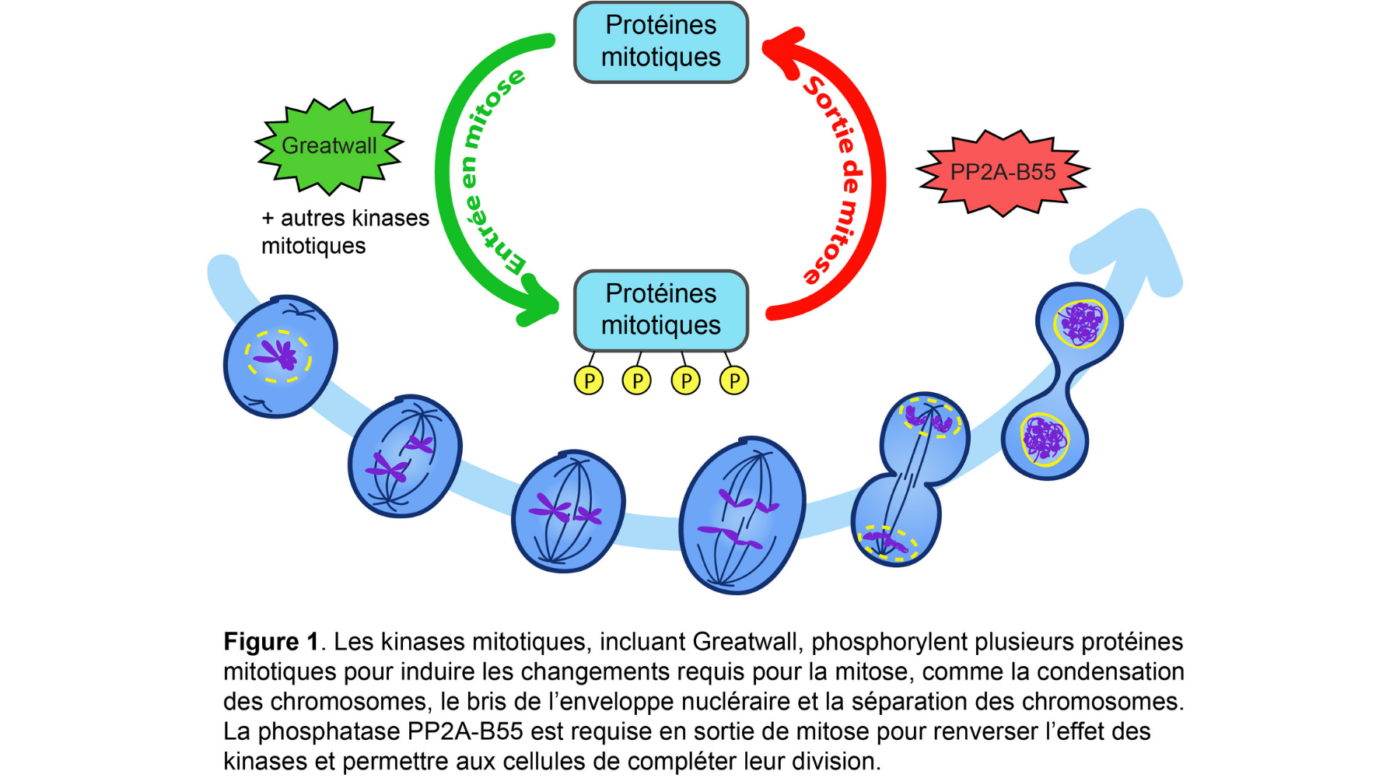
Plusieurs enzymes régulatrices, fortement conservées entre les espèces, permettent la progression ordonnée de la mitose. Certaines, les kinases, modifient les protéines en leur ajoutant des groupements phosphates; c’est ce qu’on appelle la phosphorylation. D’autres, les phosphatases, s’opposent à l’action des kinases en retirant des groupements phosphates (déphosphorylation). La modification des protéines par phosphorylation peut affecter leur structure, leur activité ou leur localisation; ce qui peut grandement influencer leur fonction. (Voir Figure 1)
La phosphatase PP2A-B55 est requise en fin de mitose pour permettre aux cellules de compléter les dernières étapes de leur division. Elle doit cependant être inactivée en début de mitose pour que les différentes transformations cellulaires requises pour la mitose s’opèrent correctement. Son activité est donc régulée cycliquement : inactivée en début de mitose, activée en sortie de mitose. Les responsables de son inhibition sont la kinase Greatwall et la protéine qu’elle phosphoryle : Endos.
La régulation des enzymes mitotiques dans le temps et l’espace intracellulaires impacte leurs fonctions
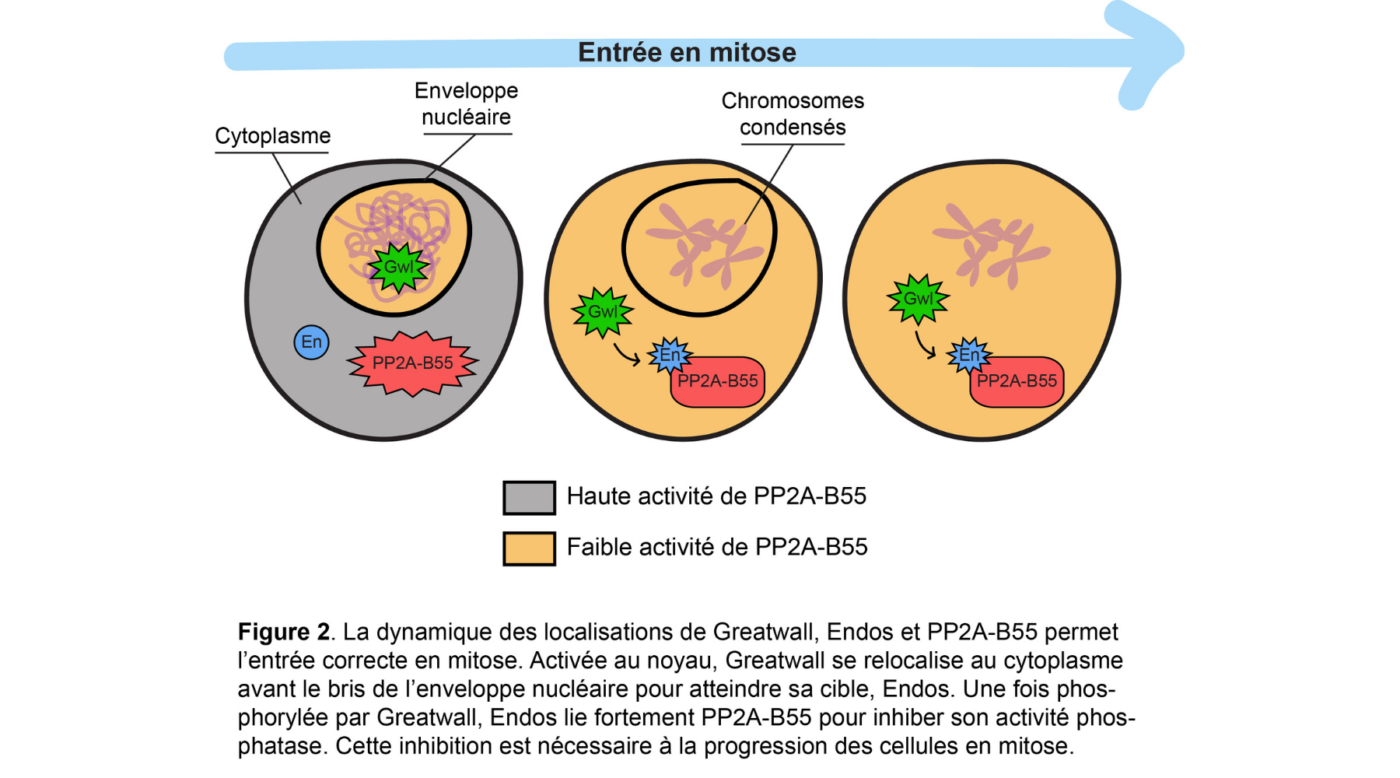
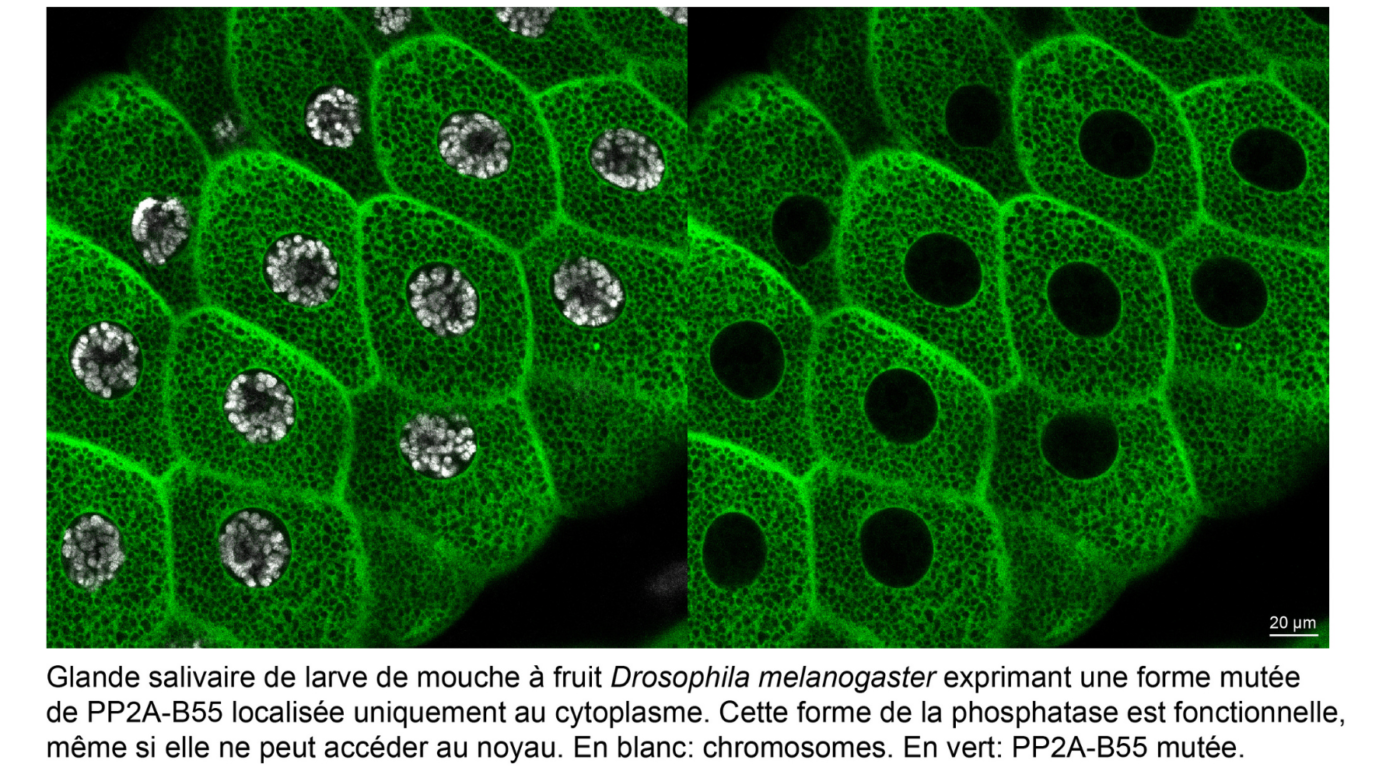
Le travail récent du laboratoire Archambault a permis de comprendre la raison, jusqu’alors inconnue, derrière le changement de localisation de Greatwall en entrée de mitose, qui passe alors soudainement du noyau au cytoplasme avant que l’enveloppe nucléaire ne se désassemble. Combinant des approches de génétique, de biologie cellulaire et de biochimie, les chercheurs ont utilisé la mouche à fruit Drosophila melanogaster pour montrer qu’Endos et PP2A-B55 accomplissent leurs fonctions essentielles dans le cytoplasme.
Leurs résultats démontrent également que la forme active de Greatwall doit accéder au cytoplasme pour phosphoryler efficacement Endos et induire son interaction avec PP2A-B55, permettant ainsi l’inhibition de la phosphatase.
Les chercheurs ont découvert que la perte de fonction d’Endos au cytoplasme, mais pas au noyau, cause de graves défauts qui compromettent le déroulement de la mitose. De plus, ces défauts sont dus à un gain d’activité de PP2A-B55 en l’absence d’Endos au cytoplasme.
La régulation temporelle précise des localisations de Greatwall, Endos et PP2A-B55 est donc essentielle pour assurer que la phosphatase PP2A-B55 soit active en interphase, mais complètement inhibée en début de mitose. Cette dynamique est cruciale pour empêcher PP2A-B55 de déphosphoryler trop hâtivement les protéines mitotiques phosphorylées dans le noyau lorsque celles-ci se retrouvent exposées au cytoplasme suite au bris de l’enveloppe nucléaire. Ces mécanismes caractérisés chez la drosophile semblent être conservés chez l’humain. (Voir Figure 2)
En somme, ces travaux apportent un nouvel éclairage sur la coordination spatiotemporelle de la machinerie moléculaire qui contrôle la mitose, aspect encore incomplètement compris du cycle de la division cellulaire.